英文原题:Regio- and Diastereoselective Aminopyridylation of Bicyclo[1.1.0]butanes with N-Aminopyridinium Ylides Enabled by Photoredox Catalysis
通讯作者:吴杰,新加坡国立大学;邓红平,南京农业大学
作者:Peng-fei Chen (陈鹏飞), Mei-Ling Chen (陈美伶),Zhexuan Lei(雷哲轩),Yu-Meng Pang (庞雨濛),Jie Wu* (吴杰),Hong-Ping Deng* (邓红平)
研究背景:
环丁胺结构由于其独特的结构特性,广泛存在于药物和农药活性分子中(图1-A),其合成一直备受关注。最近,自由基介导的双环[1.1.0]丁烷(BCBs)官能团化已成为一种构建各类环丁烷衍生物的高效方法。然而,由于环丁烷结构具有一定的“柔韧性”,导致自由基介导的BCB的Giese加成和双官能团化反应中的非对映选择性控制一直具有挑战性(图1-B)。近年来,朱晨课题组提出"对接-迁移"策略,成功地实现了自由基介导的烯烃和炔烃的选择性双官能团化,这为解决自由基介导的BCB的顺式双官能团化问题提供了一种重要的思路。2024年,Glorius团队利用该策略实现了光催化BCBs顺式双官能化,以优秀的非对映选择性地合成了一系列环丁基硫醚(图1-C)。尽管该领域研究取得了一定的进展,但已报道的例子非常有限,利用该策略选择性合成多样化的环丁烷衍生物的合成方法仍亟待开发。
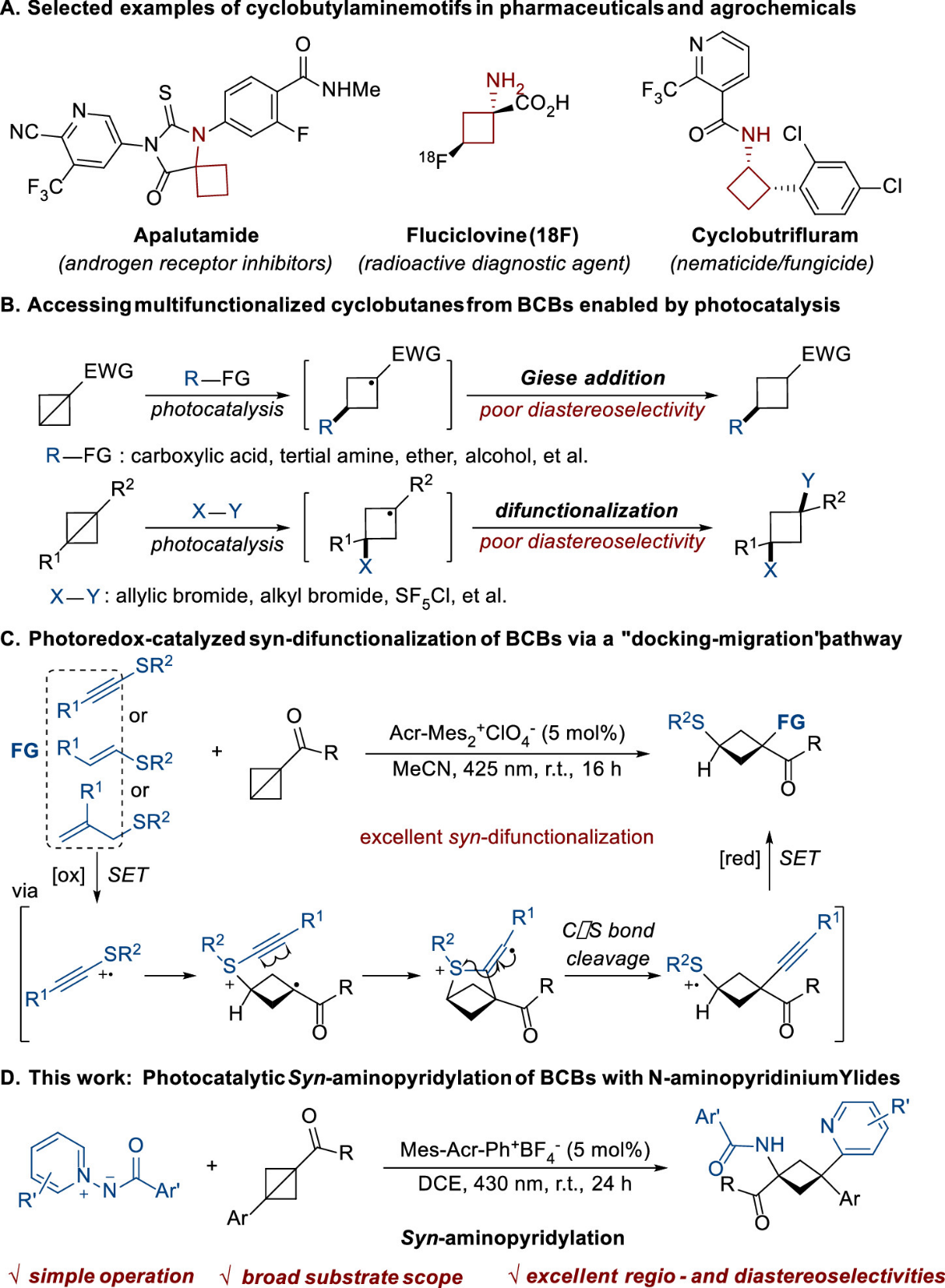
图1. 研究背景
内容介绍:
近日,南京农业大学邓红平教授与新加坡国立大学吴杰教授在Precision Chemistry上合成报道了光致氧化还原催化双环[1.1.0]丁烷与N-氨基吡啶鎓叶立德的区域及非对映选择性胺化-吡啶化的研究。本文基于“对接-迁移”的策略,利用N-氨基吡啶鎓叶立德为双官能团化试剂,发展了一种新型的可见光介导双环[1.1.0]丁烷(BCBs)的顺式胺化-吡啶化的合成方法,以优异的区域选择性和非对映选择性合成一系列环丁胺衍生物(图2)。
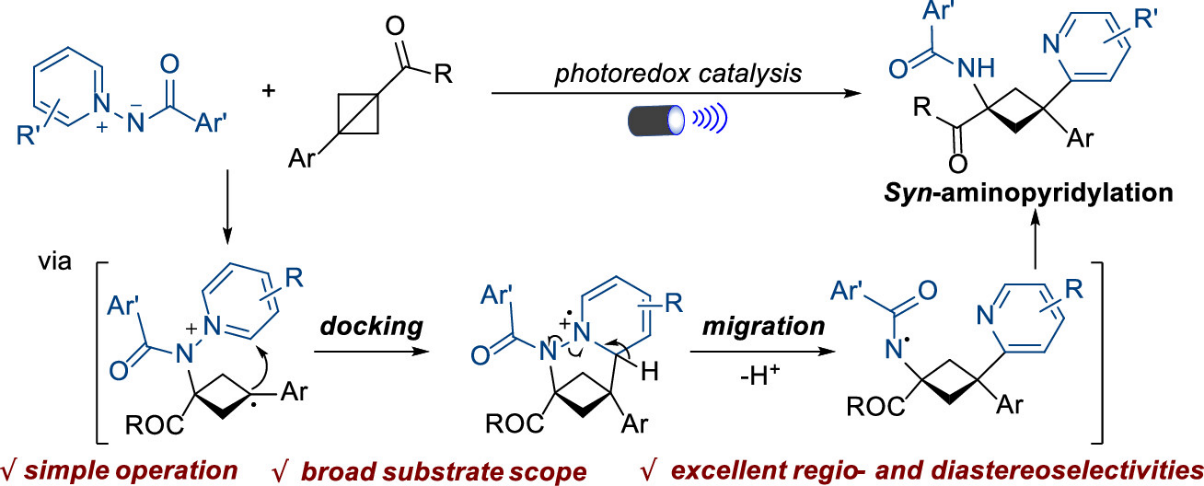
图2. 光致氧化还原催化双环[1.1.0]丁烷的区域及非对映选择性胺化-吡啶化
作者利用BCB和N-氨基吡啶鎓叶立德作为原料,并针对该胺化-吡啶化反应的条件进行了优化。在最佳反应条件下,作者对反应底物的普适性进行了考察,发现该反应能很好地兼容多种BCB和N-氨基吡啶鎓叶立德,以中等到良好的收率及优秀的区域及非对映选择性高效合成一系列环丁胺衍生物(图3)。
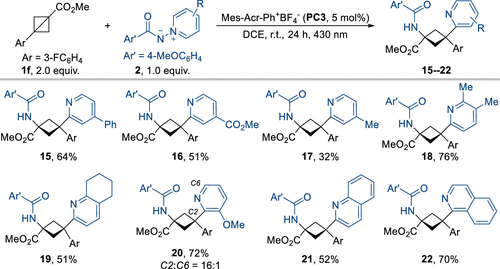
图3. 反应底物的普适性
接着,作者利用一系列控制实验(开关灯实验、荧光淬灭实验、自由基捕获实验及循环伏安法测反应物的氧化电势等)对反应的机理进行了深入研究,最终提出了反应的可能机理:激发态的光催化剂单电子氧化N-氨基吡啶鎓叶立德生成氮中心的自由基中间体I,该中间体选择性地加到BCB的酯基取代的一端生成苄基中间体II,然后中间体II依次经过分子内环化/脱质子/N-N键断裂过程得到新的氮中心自由基中间体V,最后中间体V依次经过单电子还原/质子化过程生成最终产物,并再生光催化剂,完成催化循环。
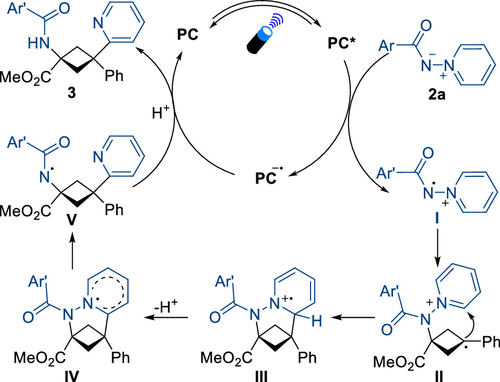
图4. 反应的可能机理
总结/展望:
本研究利用光氧化还原催化策略,在温和的条件下成功实现了双环[1.1.0]丁烷的顺式胺化-吡啶化反应。该反应兼容多种双环[1.1.0]丁烷与N-氨基吡啶鎓叶立德,以中等至良好的产率及优秀区域和非对映选择性合成一系列环丁胺衍生物,详细机理研究表明这反应经历了“对接-迁移”这一过程。
Cite this: Chen, P.-F.; Chen, M.-L.; Lei, Z.; Pang, Y.-M.; Wu, J.; Deng, H.-P. Regio- and Diastereoselective Aminopyridylation of Bicyclo[1.1.0]Butanes with N-Aminopyridinium Ylides Enabled by Photoredox Catalysis. Precision Chemistry 2025. https://doi.org/10.1021/prechem.5c00079.
