英文原题:Copper-Catalyzed Enantioconvergent Radical C(sp3)−N Cross-Coupling to Access Chiral α Amino-β-lactams
通讯作者:刘心元,南方科技大学;陈继君,南方科技大学
作者:Jing-Jing Zheng (郑靖靖), Wei-Long Liu(刘伟龙), Qiang-Shuai Gu(顾强帅), Zhong-Liang Li(李忠良), Ji-Jun Chen* (陈继君), Xin-Yuan Liu* (刘心元)
研究背景:
手性β-内酰胺是一类重要的杂环化合物,广泛存在于天然产物和药物分子中。其中,手性α-氨基-β-内酰胺化合物在医药领域中具有显著的潜力,如青霉素、诺卡菌素等,具有显著的抗菌活性。传统的合成方法通常依赖于手性辅基,而最近的研究表明催化不对称反应提供了更有效的路径但相关策略依然十分有限。
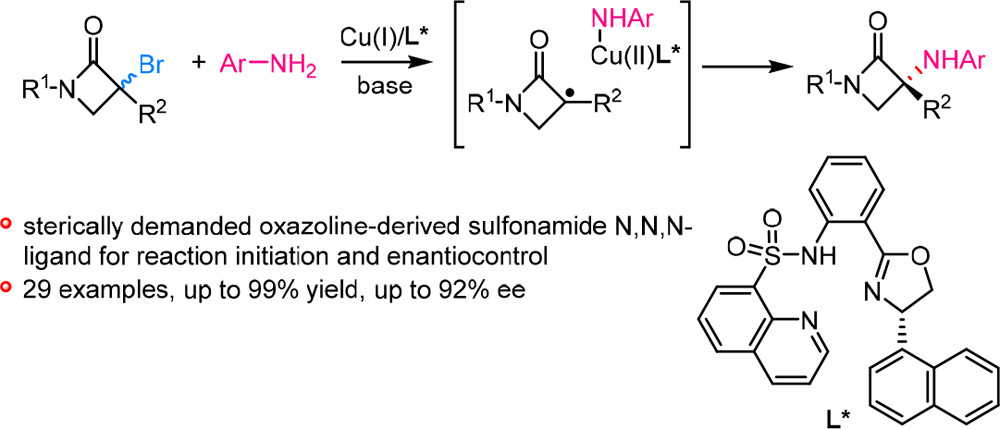
南方科技大学刘心元团队在自由基不对称催化领域中发展了“铜/手性阴离子催化剂为新型单电子转移催化剂”的策略,利用手性阴离子配体调控金属铜的氧化还原电势,引发卤代烷烃产生烷基自由基,然后通过多种手性诱导模式实现烷基自由基物种的对映选择性控制,为自由基不对称催化反应提供了一种新策略(J. Am. Chem. Soc. 2022, 144, 17319 (Perspective))。基于此,刘心元团队利用铜/多齿配体催化体系实现了外消旋三级α-溴-β-内酰胺与芳胺的立体汇聚式C(sp3)−N交叉偶联反应,高效,高对映选择性地构筑了一系列具有潜在生物医药应用前景的手性α-氨基-β-内酰胺。
内容介绍:
近日,南方科技大学刘心元教授团队在Precision Chemistry上发表了铜催化立体汇聚式C(sp3)−N交叉偶联反应构筑手性α-氨基-β-内酰胺的研究工作。该反应成功的关键在于使用了噁唑啉衍生的磺酰胺N,N,N-配体,不仅增强了铜催化剂的还原能力,引发卤代烃生成前手性的烷基自由基物种,同时手性配体对三级环烷基自由基进行有效的对映区分,实现了芳胺参与反应的手性控制。这一策略高效、高对映选择性地构筑了手性α-氨基-β-内酰胺,为制备生物活性分子中的重要结构单元提供了新的途径。
研究团队首先以三级α-溴-β-内酰胺E1和芳胺A1为模板底物,对配体、反应溶剂、温度等条件进行筛选,最终以良好的产率(86%)和优秀的对映选择性(92% ee)得到产物1(图1)。
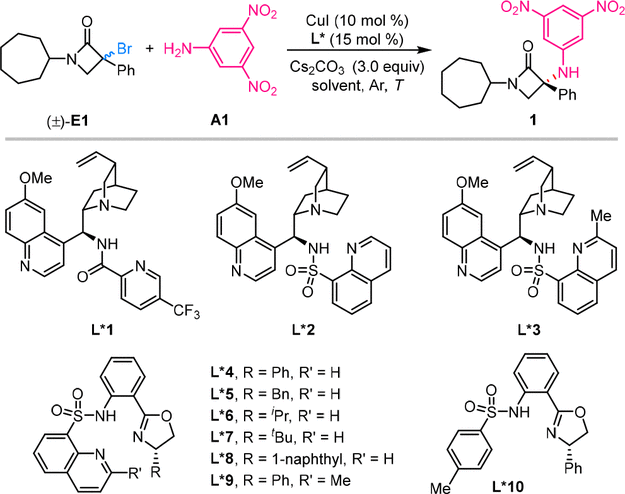
ligand | solvent | T(C) | yield (%) | ee (%) | |
1 | L*1 | benzene | 25 | trace | – |
2 | L*2 | benzene | 25 | 21 | 37 |
3 | L*3 | benzene | 25 | 10 | 10 |
4 | L*4 | benzene | 25 | 85 | 86 |
5 | L*5 | benzene | 25 | 69 | 81 |
6 | L*6 | benzene | 25 | 81 | 74 |
7 | L*7 | benzene | 25 | 86 | 81 |
8 | L*8 | benzene | 25 | 83 | 88 |
9 | L*9 | benzene | 25 | 84 | 56 |
10 | L*10 | benzene | 25 | trace | – |
11 | L*8 | 1,4-dioxane | 25 | 84 | 88 |
12 | L*8 | THF | 25 | 81 | 87 |
13 | L*8 | DME | 25 | 81 | 87 |
14 | L*8 | EtOAc | 25 | 89 | 88 |
15 | L*8 | EtOAc | 10 | 86 | 89 |
16 | L*8 | EtOAc | 0 | 86 | 92 |
17 | L*8 | EtOAc | –5 | 83 | 92 |
图1. 反应条件优化
在最优反应条件下,研究团队对底物的普适性进行了考察。具有不同电性取代基的α-溴-β内酰胺底物都能很好地兼容,包括各类含环烷基、未官能团化烷基以及官能团化的芳环的α-溴-β-内酰胺底物,都能以优异的收率(62-99%)和81-92%的对映选择性获得目标手性α-氨基-β-内酰胺产物。此外,不同吸电子取代基的芳胺均可兼容这一反应,以较高产率和对映选择性获得目标产物。然而,苯胺和富电子芳胺只能以较低的对映选择性获得相应产物(图2)。
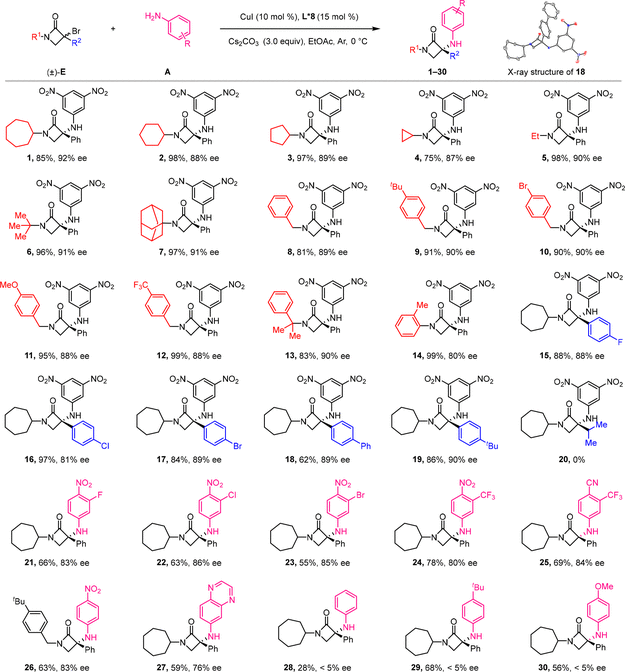
图2. 底物范围考察
为了深入了解反应机理,研究团队设计并进行了一系列的控制实验:(1)模板反应在没有胺A1或配体L*8的情况下,都没有观察到E1的转化。这表明,配体、铜和胺三者形成的手性配体螯合的Cu(I)-氨基配合物可能是催化循环的第一步;(2)通过自由基抑制试验证明了反应可能涉及自由基过程;(3)通过自由基钟实验证明了反应过程中生成了三级环烷基自由基物种。基于上述实验,研究团队提出反应的可能机理:首先,在碱存在下,Cu(I)与手性配体L*反应生成Cu(I)L*配合物I。随后,配合物I与芳胺进行配体交换生成L*Cu(I)-氨基配合物II。接着,中间体II通过单电子还原过程将外消旋α-溴-β-内酰胺还原生成前手性烷基自由基III。最后,自由基III与二价铜物种IV相互作用实现对映选择性C(sp3)−N偶联,并再生Cu(I)L*配合物I从而完成催化循环(图3)。
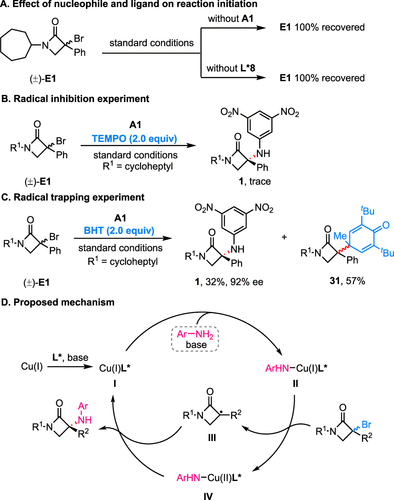
图3. 反应机理研究
总结/展望:
南方科技大学刘心元教授课题组以铜/多齿N,N,N-配体催化体系成功实现了外消旋三级α-溴-β-内酰胺与芳胺的立体汇聚式C(sp3)−N交叉偶联反应,高效、高对映选择性地构筑了手性α-氨基-β-内酰胺,为制备生物活性分子中的重要结构单元提供了新的途径。该方法的开发为有机合成领域的研究和应用提供了广阔的前景。
Cite this: Zheng, J.-J.; Liu, W.-L.; Gu, Q.-S.; Li, Z.-L.; Chen, J.-J.; Liu, X.-Y. Copper-Catalyzed Enantioconvergent Radical C(Sp3)–N Cross-Coupling to Access Chiral α-Amino-β-Lactams. Precision Chemistry 2023, 1 (10), 576–582. https://doi.org/10.1021/prechem.3c00084.
