英文原题:Catalytic Asymmetric Diastereodivergent Synthesis of 2-Alkenylindoles Bearing both Axial and Central Chirality
通讯作者:石枫,江苏师范大学/常州大学;张宇辰,江苏师范大学;倪绍飞,汕头大学
作者:Shuang Yang (杨爽),‡ Jia-Bo Huang (黄嘉博),‡ Da-Hua Wang (王大华),‡ Ning-Yi Wang (王宁宜), Yu-Yu Chen (陈瑜瑜), Xin-Yan Ke (柯欣雁), Hao Chen (陈昊), Shao-Fei Ni (倪绍飞),* Yu-Chen Zhang (张宇辰)* and Feng Shi (石枫)*
研究背景:
多重手性化合物在药物化学与材料化学等领域具有重要的应用价值,这类化合物的绝对及相对构型都会影响其物理性质及药理性质,因此,获得多重手性化合物的所有立体异构体具有重要的意义。催化不对称非对映发散性合成从相同的原料出发,仅轻微改变反应条件,就可以获得多重手性化合物的所有立体异构体,是获得多重手性化合物所有立体异构体最高效的方式之一。目前,利用这一策略合成多重中心手性化合物发展的较为成熟(图1a),但是,催化不对称非对映发散性合成兼具轴手性与中心手性化合物的研究却非常少(图1b)。这一领域主要存在以下挑战性问题:1)如何控制轴手性与中心手性,以获得较好的对映及非对映选择性;2)如何调控反应条件,实现两种手性元素的非对映发散性产生。
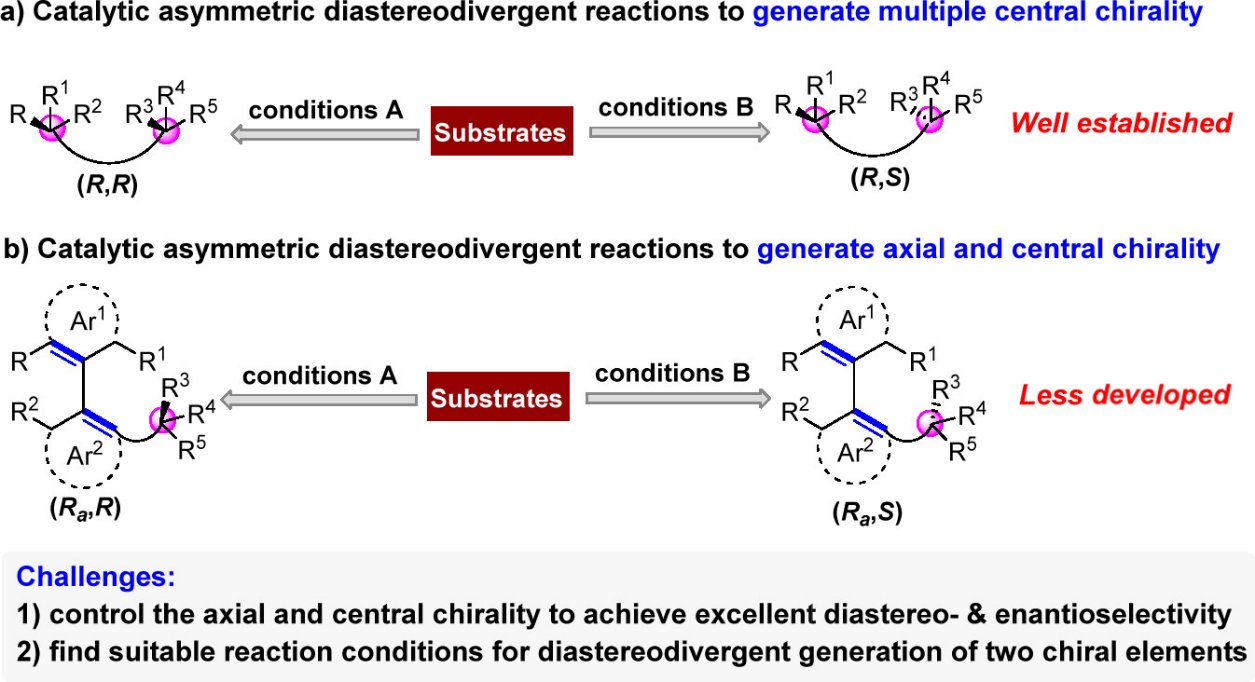
图1. 催化不对称非对映发散性合成的概述
轴手性吲哚骨架广泛存在于众多天然产物、生物活性分子、手性催化剂之中,这类骨架的催化不对称构建成为一个新兴的研究领域。近年来,化学家们通过不对称催化的策略相继构建了结构多样的轴手性(杂)芳基吲哚骨架(图2a),与之相比,更具挑战性的轴手性乙烯基吲哚骨架的催化不对称构建发展的较为缓慢(图2b)。目前,仅有一些合成轴手性3-乙烯基吲哚、N-乙烯基吲哚的报道,旋转能垒更低的2-乙烯基吲哚的催化不对称构建一直没有实现。如何克服轴手性2-乙烯基吲哚较低的构型稳定性,发展高效的策略实现此类骨架的构建是这一领域的难点。
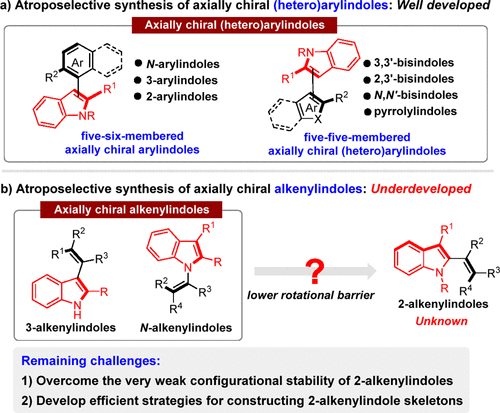
图2. 轴手性吲哚催化不对称合成的概述
内容介绍:
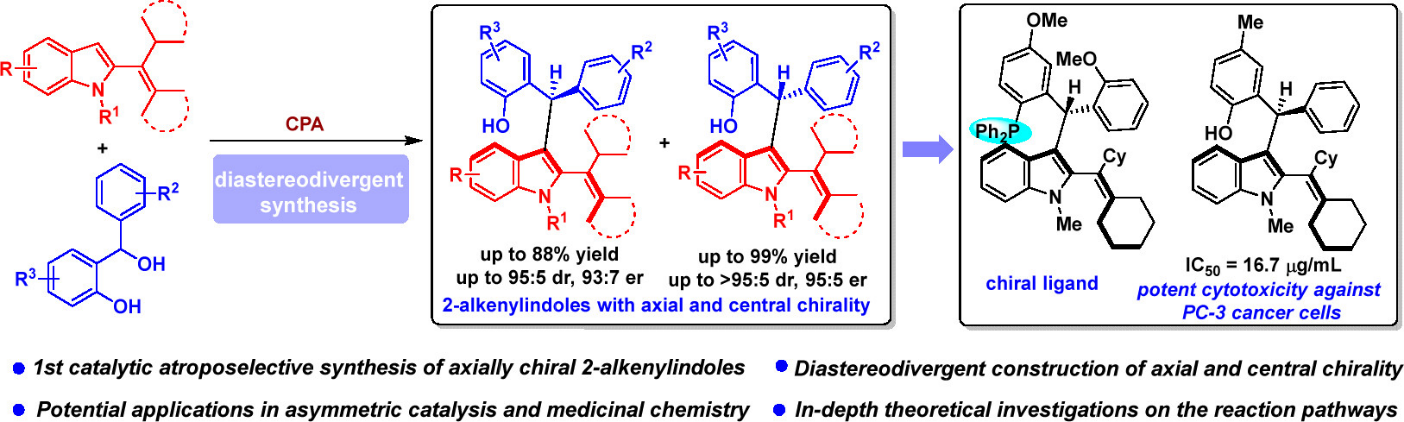
为解决兼具轴手性与中心手性化合物催化不对称非对映发散性合成中的挑战性问题,并实现轴手性2-乙烯基吲哚的高效构建,江苏师范大学石枫教授、张宇辰教授等设计开发了C3-未取代2-乙烯基吲哚作为新型的吲哚平台分子,通过调控反应条件,实现了兼具轴手性及中心手性的2-乙烯基吲哚的催化不对称非对映发散性合成。
作者设计的C3-未取代2-乙烯基吲哚平台分子具有以下特性(图3a):1)吲哚环中未取代的C3位不仅可以作为亲核位点参与反应,同时还可以让吲哚环与烯烃片段自由旋转,从而实现平台分子的快速消旋化;2)烯烃片段及吲哚N1位的大位阻取代基能够使产物旋转受阻,从而增强产物的构型稳定性;3)这类平台分子通过相应吲哚醇的脱水反应即可合成,制备方法简单。以上特性使得C3-未取代2-乙烯基吲哚能够与具有潜中心手性的大位阻亲电试剂发生催化不对称加成反应,通过调控反应条件,从而非对映发散性地合成兼具轴手性及中心手性的2-乙烯基吲哚。在此设计中,仍有一些问题需要解决:1)寻找合适的具有潜中心手性的大位阻亲电试剂;2)选择合适的催化策略,实现反应活性及立体选择性的控制。
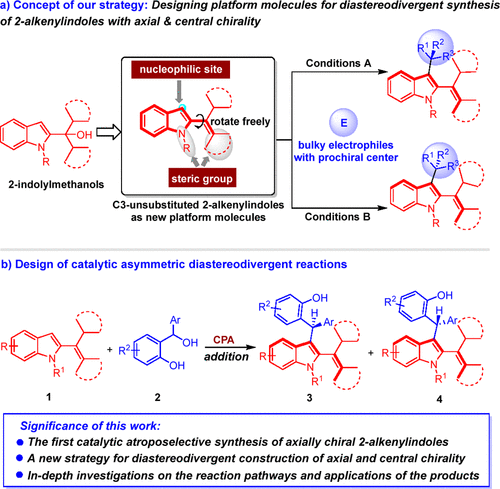
图3. 催化不对称非对映发散性合成兼具轴手性及中心手性的2-乙烯基吲哚的设计
为了解决这些问题,作者设计了手性磷酸催化下C3-未取代2-乙烯基吲哚与邻羟基苄醇的不对称加成反应(图3b)。选择邻羟基苄醇作为具有潜中心手性的大位阻亲电试剂,是由于邻羟基苄醇在Brønsted酸活化下可以转化成成高活性的邻亚甲基苯醌中间体,在发生加成反应的同时能够产生中心手性。选择手性磷酸作为高效的催化剂,是基于手性磷酸在活化邻羟基苄醇中的优势。
作者选用2-乙烯基吲哚1a与邻羟基苄醇2a作为底物尝试此反应(图4),发现使用3,3’位带有不同取代基的手性磷酸能够调控反应的非对映选择性,经过详细的条件优化,最终以52%收率、92:8 er、95:5 dr (3aa:4aa)获得产物3aa (conditions A);以99% 收率、93:7 er、92:8 dr (4aa:3aa)获得化合物4aa (conditions B)。
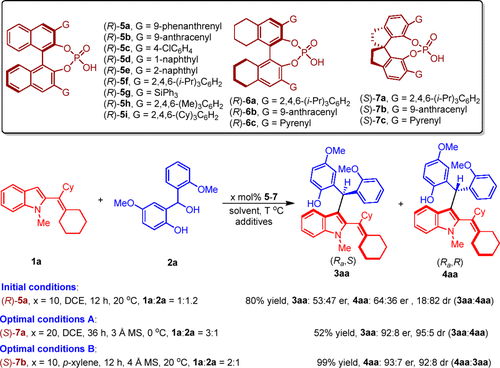
图4. 反应条件优化
确定最优反应条件之后,作者首先以conditions A作为反应条件,考察了合成产物3的底物适用范围(图5)。带有不同取代基的2-乙烯基吲哚1以及邻羟基苄醇2都能适用于该反应,以中等至较高的收率、较好的非对映选择性和对映选择性得到结构多样的兼具轴手性与中心手性的2-乙烯基吲哚化合物3。
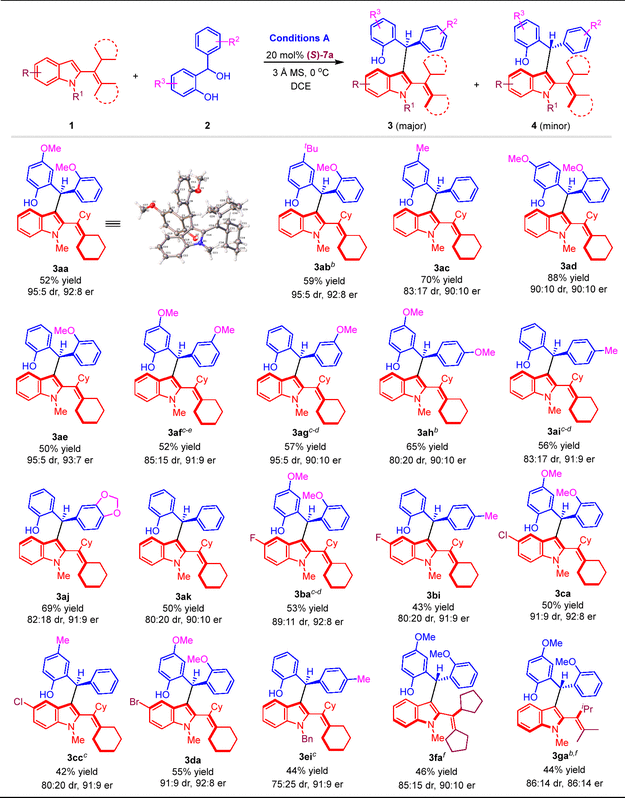
图5. 合成产物3的底物适用范围研究
作者进一步以conditions B作为反应条件,考察了合成产物4的底物适用范围(图6)。带有不同取代基的2-乙烯基吲哚1以及邻羟基苄醇2都能适用于该反应,以中等至较高的收率、较好的非对映选择性和对映选择性得到结构多样的兼具轴手性与中心手性的2-乙烯基吲哚化合物4。
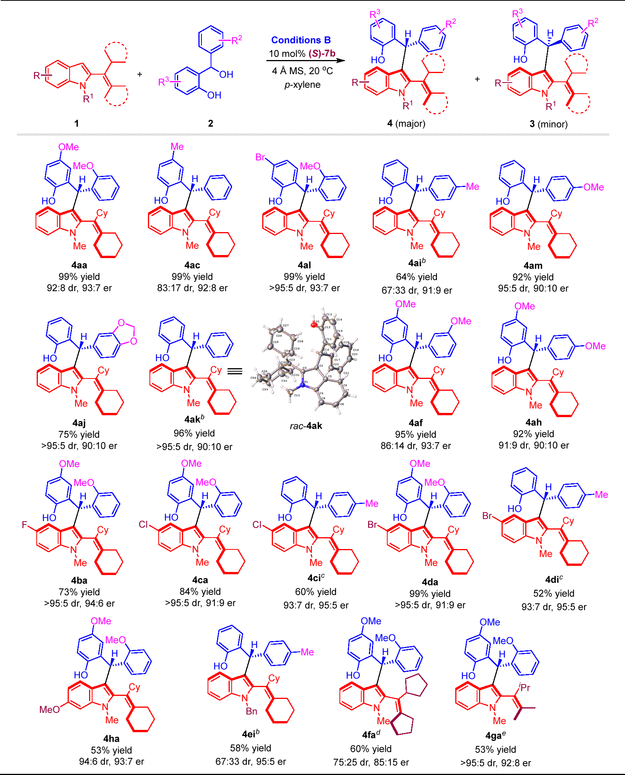
图6. 合成产物4的底物适用范围研究
在此基础上,作者通过改变反应条件及催化剂的构型研究了该反应的立体发散性,分别以中等至良好的收率、较高的非对映选择性和对映选择性得到了多重手性元素2-乙烯基吲哚的四个立体异构体(图7a)。此外,作者还进行了产物稳定性研究,结果表明该类轴手性骨架具有较高的化学稳定性和构型稳定性(图7b)。作者通过理论计算发现产物3aa和4aa具有较高的旋转能垒,分别为39.5 kcal·mol-1和46.3 kcal·mol-1,与稳定性实验结果一致。
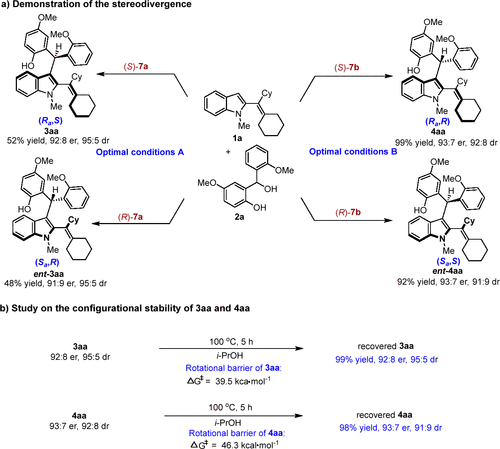
图7 立体发散性合成验证与构型稳定性研究
随后,作者进行了1 mmol规模放大量实验,反应结果与0.1mmol规模相似(图8a)。为了研究产物的用途,作者将产物4aa转化成手性膦配体9,这类手性配体在烯丙基碳酸酯11与丙二酸二乙酯12的催化不对称烯丙基化反应中表现出了较好的催化活性(图8b)。该结果表明这类多重手性元素2-乙烯基吲哚在手性催化剂开发中具有较为广阔的应用前景。
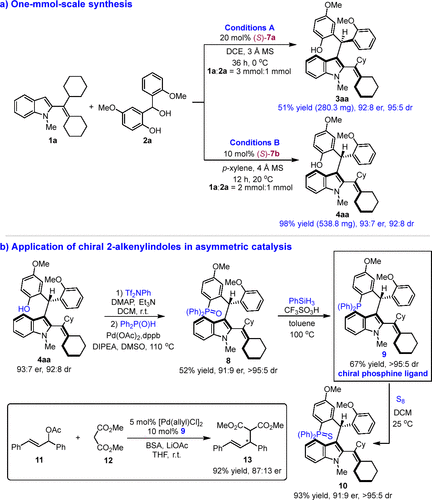
图8放大量实验及产物在不对称催化中应用
为了探究该类骨架可能的生物活性,作者对产物进行了抗肿瘤活性筛选,发现部分产物对HepG2和PC-3肿瘤细胞具有较好的细胞毒活性(图9)。
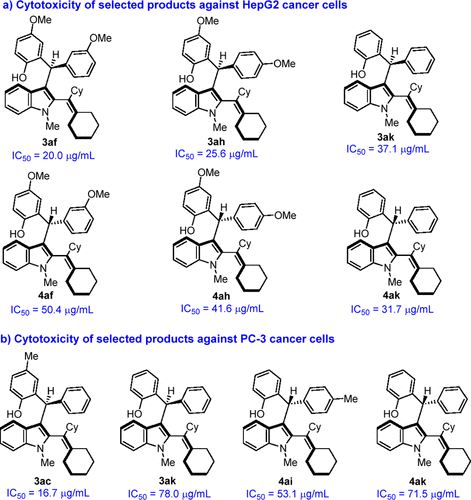
图9具有较好抗肿瘤活性的多重手性2-乙烯基吲哚衍生物3和4
通过控制实验,作者认为邻羟基苄醇脱水形成邻亚甲基苯醌中间体(o-QM),进而与手性磷酸形成氢键对反应活性的控制具有重要作用(图10a)。基于这一结果,作者提出了可能的反应路径(图10b)。化合物1a的旋转能垒为21.4 kcal·mol-1,这表明(Ra)-1a和(Sa)-1a可以快速相互转化。在手性磷酸(S)-7a及(S)-7b活化下,(Ra)-1a与邻羟基苄基醇2a脱水生成的邻亚甲基苯醌中间体(o-QM)迅速发生亲核加成反应,非对映发散性生成相应产物(Ra,S)-3aa及(Ra,R)-4aa。与之相比,由于构型匹配的问题,(Sa)-1a与o-QM的亲核加成反应非常缓慢,(Sa)-1a反而会通过快速消旋化过程转化为(Ra)-1a,从而实现动态动力学转化。
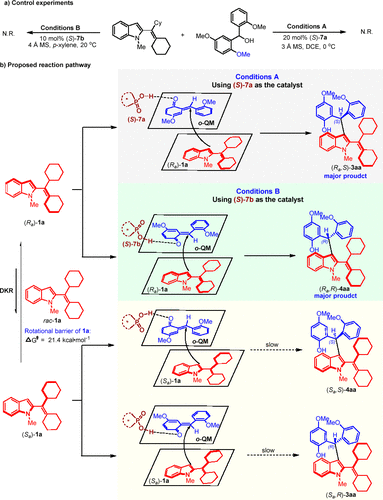
图10 控制实验以及可能的反应路径
为了深入理解反应获得较好对映选择性及非对映发散性的原因,石枫课题组与汕头大学倪绍飞博士合作,对该催化不对称加成反应进行了理论计算(图11)。如图11a所示,生成主产物(Ra,S)-3aa的过渡态(Ra,S)-TS1的能垒最低(19.4 kcal·mol-1),与形成次要对映异构体(Sa,R)-3aa的关键过渡态(Sa,R)-TS1相差1.7 kcal·mol1,这与产物3aa获得92:8 er的对映选择性保持一致。此外,生成主产物(Ra,R)-4aa的过渡态(Ra,R)-TS2的能垒最低(19.3 kcal·mol-1),与形成次要对映异构体(Sa,S)-4aa的关键过渡态(Sa,S)-TS2相差2.2 kcal·mol1,这也很好的解释了产物4aa获得较好对映选择性(93:7 er)的原因(图11b)。
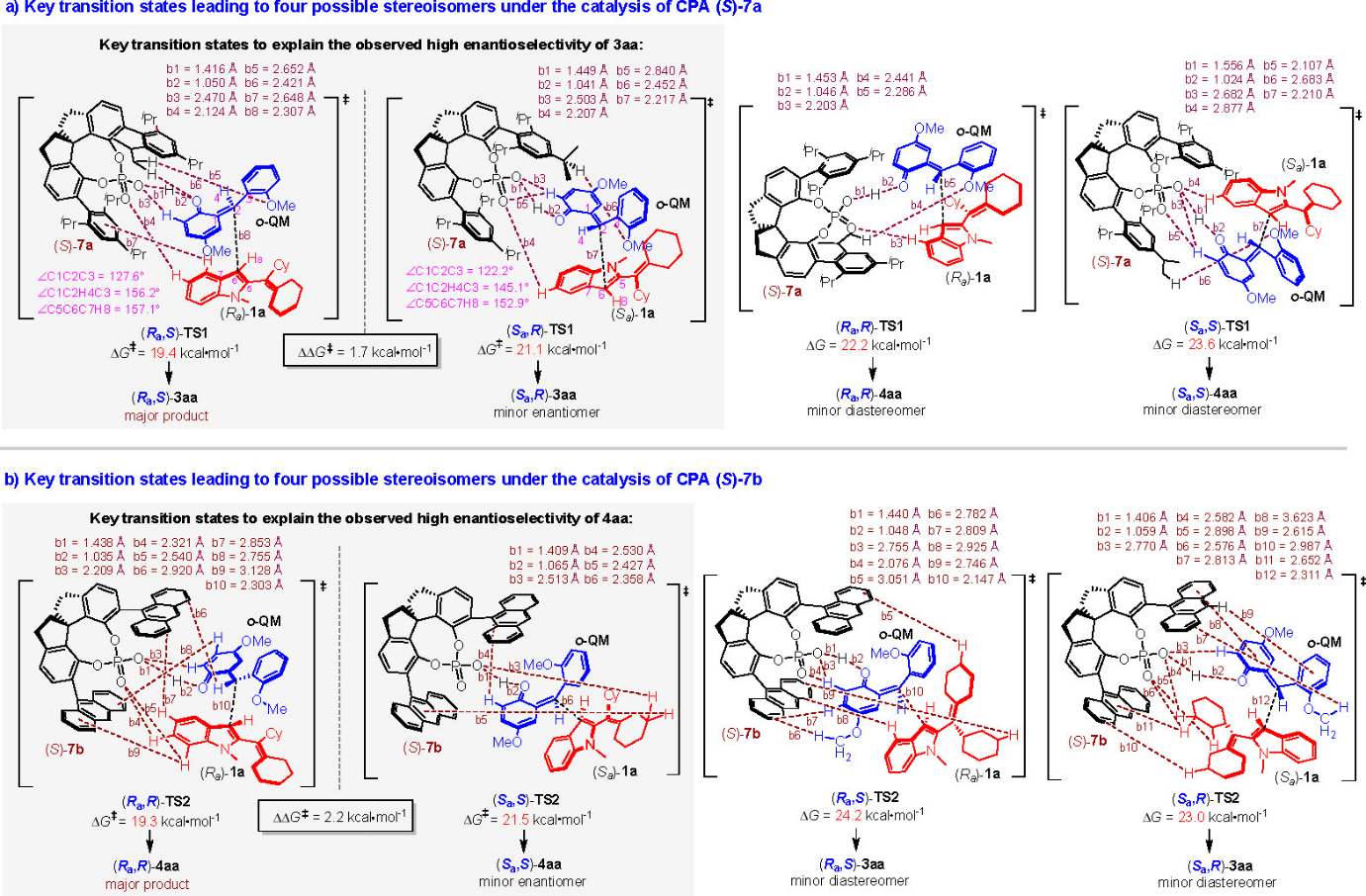
图11 产生四种立体异构体的关键过渡态
总结/展望:
石枫、张宇辰等基于手性磷酸催化下C3-未取代2-乙烯基吲哚与邻羟基苄醇的不对称加成反应,首次实现了兼具轴手性及中心手性的2-乙烯基吲哚的催化不对称合成。通过调控反应条件,非对映发散性地合成了两类多重手性元素2-乙烯基吲哚,并初步探索了这类骨架在不对称催化与药物化学中的应用。此外,作者通过理论计算研究了产生四种立体异构体的关键过渡态,深化了对该类催化不对称非对映发散性反应的认识。该研究不仅首次实现了轴手性2-乙烯基吲哚的催化不对称合成,还为兼具轴手性与中心手性化合物的非对映发散性合成提供了高效的策略。
Cite this: Yang, S.; Huang, J.-B.; Wang, D.-H.; Wang, N.-Y.; Chen, Y.-Y.; Ke, X.-Y.; Chen, H.; Ni, S.-F.; Zhang, Y.-C.; Shi, F. Catalytic Asymmetric Diastereodivergent Synthesis of 2-Alkenylindoles Bearing Both Axial and Central Chirality. Precision Chemistry 2024, 2 (5), 208–220. https://doi.org/10.1021/prechem.4c00008.
